10ª aula
Mudanças de fase (III)
Borges e Nicolau
Influência da pressão nas temperaturas de fusão e de ebulição
A maioria das substâncias aumenta de volume na fusão e, portanto, diminui de volume ao se solidificar. Para estas substâncias, um aumento de pressão acarreta um aumento na temperatura de fusão.
Clique para ampliar
Existem exceções, como por exemplo a água. Para estas substâncias o volume diminui na fusão e, portanto, aumenta na solidificação. Para as exceções, um aumento de pressão acarreta uma diminuição na temperatura de fusão.
Clique para ampliar
Para todas as substâncias, um aumento de pressão acarreta um aumento na temperatura de ebulição.
Clique para ampliar
Diagrama de fases
Maioria das substâncias (como por exemplo o CO2)
Clique para ampliar
Exceções (como por exemplo a água)
Clique para ampliar
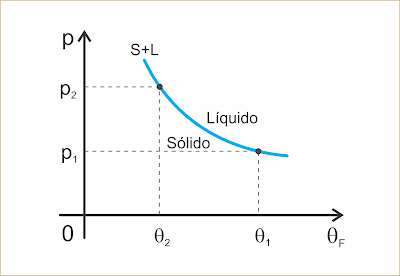
Curva de fusão (1)
Delimita as regiões correspondentes às fases sólida e líquida. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
Curva de vaporização (2)
Delimita as regiões correspondentes às fases líquida e de vapor. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
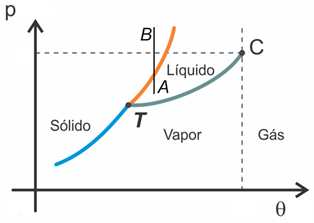
Curva de sublimação (3)
Delimita as regiões correspondentes às fases sólida e de vapor. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
Ponto triplo ou tríplice (T)
Estado comum às três curvas; é representativo do equilíbrio entre as três fases da substância.
Ponto crítico (C)
Estado em que corresponde à mais alta temperatura em que a substância é um vapor.
Vapor (θ ≤ θc): liquefaz-se por compressão isotémica.
Gás (θ > θc): não se liquefaz por compressão isotérmica.
Clique para ampliar
Animação:
Diagrama de fases
Clique aqui
Exercícios básicos
Exercício 1:
Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
a) O volume da substância diminui com a solidificação.
b) Os estados sólido e líquido desta substância têm mesma densidade.
c) Para esta substância um aumento de pressão acarreta uma diminuição na temperatura de fusão.
d) Para esta substância um aumento de pressão acarreta um aumento na temperatura de fusão.
e) A temperatura de fusão desta substância é a mesma, qualquer que seja a pressão sobre ela exercida.
Resolução:
Se a porção
sólida flutua no líquido, concluímos que a densidade da substância no
estado sólido é menor do que no estado líquido. Logo, esta substância ao
se solidificar aumenta de volume. Ela pertence às exceções. Portanto,
para ela um aumento de pressão acarreta uma diminuição na temperatura de
fusão.
Resposta: c
x
Exercício 2:
Um aumento da pressão sobre o gelo faz com que sua temperatura de fusão:
a) mantenha-se constante
b) diminua
c) aumente
d) aumente e a seguir diminua
e) diminua e a seguir aumente
Resolução:
A água é uma exceção. Um aumento de pressão sobre o gelo acarreta uma diminuição na temperatura de fusão.
Resposta: b
x
Exercício 3:
Você sabe que a água entra em ebulição a 100 ºC quando sob pressão normal (1 atm). É possível ferver a água à temperatura ambiente?
Resolução:
Sim, desde que a pressão sobre a água seja bem menor do que 1 atm.
Exercício 4:
Analise a proposição abaixo e assinale se está certa ou errada.
"O ponto de ebulição da água é sempre 100 ºC em qualquer ponto da superfície terrestre, mesmo que ela esteja sendo fervida em recipientes abertos e em locais de altitudes diferentes".
Resolução:
Com o aumento da altitude diminui a pressão sobre a água e menor é a temperatura de ebulição.
x
Exercício 5:
Analise a proposição abaixo e assinale se está certa ou errada.
"Quando a água é aquecida numa panela de pressão fechada, a temperatura atingida é maior do que 100 ºC pois a pressão no interior da panela é maior do que 1 atm".
Resolução:
Certa. Quanto maior a pressão maior é a temperatura de ebulição.
x
Exercício 6:
O diagrama de fases apresentado abaixo é de uma substância hipotética.
Clique para ampliar
a) Em que fase a substância se encontra quando sob pressão de 300 mm Hg e à temperatura de 10 ºC?
b) Em que fase a substância se encontra quando sob pressão de 300 mm Hg e à temperatura de 30 ºC?
c) Qual é o nome da mudança de fase que ocorre quando a substância passa de B para A?
d) Qual é o nome da mudança de fase que ocorre quando a substância passa de D para E?
e) Em que fase a substância não poderá se encontrar se estiver submetida a uma pressão inferior à do ponto triplo T?
f) Sendo C o ponto crítico, é possível liquefazer a substância, por meio de uma compressão isotérmica, estando à temperatura de 70 ºC?
Resolução:
a) Sólida: corresponde ao ponto A do diagrama
b) Líquida: corresponde ao ponto B do diagrama
c) Solidificação: a substância passa do estado líquido para o estado sólido.
d) Liquefação ou Condensação: a substância passa do estado gasoso para o estado líquido
e) A substância não poderá estar na fase Liquida
f) Para θ > θc, a substância (gás) não se liquefaz por compressão isotérmica.
Respostas:
a) Sólida
b) Líquida
c) Solidificação
d) Liquefação ou Condensação
e) Liquida
f) Não é possível liquefazer
Exercícios de revisão
Revisão/Ex 1:
(Fatec–SP)
Uma porção de certa substância está passando do estado líquido para o estado sólido. Verifica-se que o sólido que se forma flutua sobre a parte ainda líquida. Com essa observação, é correto concluir que:
a) a densidade da substância aumenta com a solidificação
b) a massa da substância aumenta com a solidificação
c) a massa da substância aumenta com a fusão
d) o volume da substância aumenta com a fusão
e) o volume da substância aumenta com a solidificação
Resolução:
Se o sólido que se forma flutua sobre a parte ainda líquida, concluímos que a densidade do sólido é menor do que a do líquido. Logo, o volume da substância aumenta na solidificação.
Resposta: e
Revisão/Ex 2:
(Unifor–CE)
Acerca das mudanças de fase das substâncias, considere as afirmativas que seguem.
I. Se uma substância aumenta de volume ao sofrer fusão, um aumento de pressão sobre ela deverá diminuir o seu ponto de fusão.
II. Um líquido pode se solidificar, à temperatura constante, apenas por elevação da pressão sobre ele.
III. Uma substância, mantida à temperatura constante e menor que a do ponto tríplice, pode passar do estado sólido ao gasoso apenas por redução da pressão.
Dentre essas afirmativas, somente:
a) I é correta. b) II é correta. c) III é correta.
d) I e II são corretas. e) II e III são corretas.
Resolução:
I. Incorreta. Se a substância aumenta de volume ao sofrer fusão ela pertence à maioria das substâncias. Portanto, um aumento de pressão sobre ela deverá aumentar o seu ponto de fusão.
II. Correta. Um líquido pode se solidificar à temperatura constante apenas por elevação da pressão sobre ele, conforme se observa no diagrama abaixo (A→B):
III. Correta. Uma substância, mantida à temperatura constante e menor que a do ponto tríplice, pode passar do estado sólido ao gasoso apenas por redução da pressão, conforme se observa no diagrama abaixo (A→B):
Resposta: e
Revisão/Ex 3:
(VUNESP)
A liofilização é um processo de desidratação de alimentos que, além de evitar que seus nutrientes saiam junto com a água, diminui bastante sua massa e seu volume, facilitando o armazenamento e o transporte. Alimentos liofilizados também têm seus prazos de validade aumentados, sem perder características como aroma e sabor.
O processo de liofilização segue as seguintes etapas:
I. O alimento é resfriado até temperaturas abaixo e 0 °C para que a água contida nele seja solidificada.
II. Em câmaras especiais, sob baixíssima pressão (menores do que 0,006 atm), a temperatura do alimento é elevada, fazendo com que a água sólida seja sublimada.
Dessa forma, a água sai do alimento sem romper suas estruturas moleculares, evitando perdas de proteínas e vitaminas.
O gráfico mostra parte do diagrama de fases da água e cinco processos de mudança de fase, representados pelas setas numeradas de 1 a 5.
A alternativa que melhor representa as etapas do processo de liofilização, na ordem descrita, é:
a) 4 e 1. b) 2 e 1. c) 2 e 3.
d) 1 e 3. e) 5 e 3.
Resolução:
I. Ao se resfriar o alimento até temperaturas abaixo de 0 °C, a água nele contida se solidifica. Assim, tem-se a passagem do estado líquido para o sólido, o que é representado pela seta 2.
II. A sublimação, passagem direta do estado sólido para o estado gasoso, é representada pela seta 3.
Resposta: c
Revisão/Ex 4:
(UDESC-SC)
Para cada substância simples pode-se fazer um gráfico, denominado diagrama de fase, em que cada ponto corresponde a uma combinação de pressão e temperatura bem definidas. Essa combinação de pressão e temperatura determina a fase da substância. A figura mostra o diagrama de fase da água.
Analisando o diagrama de fase da água, todas as alternativas estão corretas, exceto a:
a) O ponto A é o ponto triplo da água.
b) A água está na fase gasosa no ponto Z.
c) A curva AB é a curva de vaporização.
d) A água está na fase sólida no ponto X.
e) O ponto B é o ponto de ebulição da água nas condições normais de temperatura (0 °C) e pressão (1 atm).
Resolução:
No estado representado pelo ponto Z a água está na fase líquida.
Resposta: b
Revisão/Ex 5:
(FMABC-SP)
O gráfico representa o diagrama de fases do “gelo seco”. PT e PC representam, respectivamente, ponto triplo e ponto crítico da substância.
Analise este diagrama e assinale a alternativa correta.
a) Acima de 31 ºC, a substância apresenta-se no estado gasoso.
b) É possível liquefazer o gás apenas aumentando a temperatura de - 56,6 ºC para 31 ºC.
c) A substância apresenta-se no estado sólido para valores de pressão acima de uma atmosfera.
d) A substância apresenta-se sempre no estado líquido para a temperatura de 20 ºC.
e) A substância apresenta-se em mudança de estado para a pressão de 5,1 atm e temperatura de -10 ºC.
Resolução:
A temperatura de 31 °C corresponde à temperatura crítica do CO2. Acima desta temperatura a substância é um gás.
Resposta: a