Borges e Nicolau
Influência da pressão nas temperaturas de fusão e de ebulição
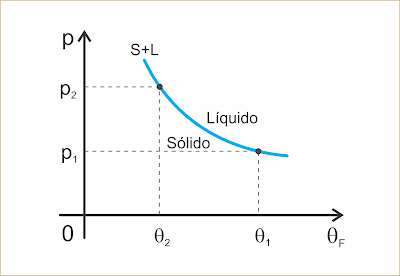
A maioria das substâncias aumenta de volume na fusão e, portanto, diminui de volume ao se solidificar. Para estas substâncias, um aumento de pressão acarreta um aumento na temperatura de fusão.
Clique para ampliar
Existem exceções, como por exemplo a água. Para estas substâncias o volume diminui na fusão e, portanto, aumenta na solidificação. Para as exceções, um aumento de pressão acarreta uma diminuição na temperatura de fusão.
Clique para ampliar
Para todas as substâncias, um aumento de pressão acarreta um aumento na temperatura de ebulição.
Clique para ampliar
Diagrama de fases
Maioria das substâncias (como por exemplo o CO2)
Clique para ampliar
Exceções (como por exemplo a água)
Clique para ampliar
Curva de fusão (1)
Delimita as regiões correspondentes às fases sólida e líquida. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
Curva de vaporização (2)
Delimita as regiões correspondentes às fases líquida e de vapor. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
Curva de sublimação (3)
Delimita as regiões correspondentes às fases sólida e de vapor. Cada ponto dela é representativo de um estado de equilíbrio entre essas fases.
Ponto triplo ou tríplice (T)
Estado comum às três curvas; é representativo do equilíbrio entre as três fases da substância.
Ponto crítico (C)
Estado em que corresponde à mais alta temperatura em que a substância é um vapor.
Vapor (θ ≤ θC): liquefaz-se por compressão isotémica.
Gás (θ > θC): não se liquefaz por compressão isotérmica.
Clique para ampliar
Exercícios básicos
Exercício 1:
Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
a) O volume da substância diminui com a solidificação.
b) Os estados sólido e líquido desta substância têm mesma densidade.
c) Para esta substância um aumento de pressão acarreta uma diminuição na temperatura de fusão.
d) Para esta substância um aumento de pressão acarreta um aumento na temperatura de fusão.
e) A temperatura de fusão desta substância é a mesma, qualquer que seja a pressão sobre ela exercida.
Resolução:
Se a porção sólida flutua no líquido, concluímos que a densidade da substância no estado sólido é menor do que no estado líquido. Logo, esta substância ao se solidificar aumenta de volume. Ela pertence às exceções. Portanto, para ela um aumento de pressão acarreta uma diminuição na temperatura de fusão.
Resposta: c
Se a porção sólida flutua no líquido, concluímos que a densidade da substância no estado sólido é menor do que no estado líquido. Logo, esta substância ao se solidificar aumenta de volume. Ela pertence às exceções. Portanto, para ela um aumento de pressão acarreta uma diminuição na temperatura de fusão.
Resposta: c
Exercício 2:
Um aumento da pressão sobre o gelo faz com que sua temperatura de fusão:
a) mantenha-se constante
b) diminuac) aumente
d) aumente e a seguir diminua
e) diminua e a seguir aumente
Resolução:
A água é uma exceção. Um aumento de pressão sobre o gelo acarreta uma diminuição na temperatura de fusão.
Resposta: b
Exercício 3:
Você sabe que a água entra em ebulição a 100 ºC quando sob pressão normal (1 atm). É possível ferver a água à temperatura ambiente?
Resolução:
Sim, desde que a pressão sobre a água seja bem menor do que 1 atm.
Exercício 4:
Analise a proposição abaixo e assinale se está certa ou errada.
"O ponto de ebulição da água é sempre 100 ºC em qualquer ponto da superfície terrestre, mesmo que ela esteja sendo fervida em recipientes abertos e em locais de altitudes diferentes".
Resolução:
Com o aumento da altitude diminui a pressão sobre a água e menor é a temperatura de ebulição.
Exercício 5:
Analise a proposição abaixo e assinale se está certa ou errada.
"Quando a água é aquecida numa panela de pressão fechada, a temperatura atingida é maior do que 100 ºC pois a pressão no interior da panela é maior do que 1 atm".
Resolução:
Certa. Quanto maior a pressão maior é a temperatura de ebulição.
Exercício 6:
O diagrama de fases apresentado abaixo é de uma substância hipotética.
Clique para ampliar
b) Em que fase a substância se encontra quando sob pressão de 300 mm Hg e à temperatura de 30 ºC?
c) Qual é o nome da mudança de fase que ocorre quando a substância passa de B para A?
d) Qual é o nome da mudança de fase que ocorre quando a substância passa de D para E?
e) Em que fase a substância não poderá se encontrar se estiver submetida a uma pressão inferior à do ponto triplo T?
f) Sendo C o ponto crítico, é possível liquefazer a substância, por meio de uma compressão isotérmica, estando à temperatura de 70 ºC?
Resolução:
a) Sólida: corresponde ao ponto A do diagrama
b) Líquida corresponde ao ponto B do diagrama
c) Solidificação: a substância passa do estado líquido para o estado sólido.
d) Liquefação ou Condensação: a substância passa do estado gasoso para o estado líquido
e) A substância não poderá estar na fase Liquida
f) Para θ > θc, a substância (gás) não se liquefaz por compressão isotérmica.
Respostas:
a) Sólida
b) Líquida
c) Solidificação
d) Liquefação ou Condensação
e) Liquida
f) Não é possível liquefazer






Nenhum comentário:
Postar um comentário